147 ノート HeHの分子軌道エネルギー準位図 Amih SAGANa,長岡 伸一b,寺前 裕之c,長嶋 雲兵a* a産業技術総合研究所ナノシステム研究部門計算科学研究領域,〒つくば市梅園111 b図1 ベンゼン(左)とシクロブタジエン(右)の分子軌道エネルギー準位。ベンゼンでは全ての電子 が対を作り閉殻構造であるのに対し、シクロブタジエンでは不対電子が2つのジラジカルであ るこ軌道のエネルギー準位 分子内に二重結合を1つもつ炭化水素をアルケン(alkene)と呼び、CnH2nで表されます。アルケンの新しい命名法では 数字エンという書き方をし、二重結合の位置を最小
単純ヒュッケル法による分子軌道の計算と共鳴安定化
ブタジエン 分子軌道 エネルギー準位
ブタジエン 分子軌道 エネルギー準位-化学の問題です ブタジエンのπ軌道について ブタジエンは一つの分子あたり二つπ軌道を持つことはわかるのですが ひとつめのπ軌道と二つ目のπ軌道では持つエネルギーが違うらしいのです。 。 。計算方法は こちら ベンゼンの分子軌道エネルギー準位 (D6h66, CC = 1399 Å, CH = 1101 Å, サンプル点数 = , SCCS) ・VEND入力ファイル: Enterを実行することにより生成されます。



Q Tbn And9gctw1c Gm Gngmfvddof1tvoqlnskjwtdlbht9d1tl 9wix8law3prhe Usqp Cau
半波電位と電子エネルギー準位との関係を最初に 明らかにしたのはMaccol1である19).彼は,上記 のH伽kelらの仕事に刺激され,共役系芳香族炭化 水素について,HOcke1近似の分子軌道分子軌道ダイアグラムは、MO エネルギー準位 の概略図( 英 diagram )である。 MOエネルギー準位は図中央に短い横線として示されており、横には比較のため構成するAOエネルギー準位が示され原子核に近い軌道ほどエネルギーが低く、遠いほどエネルギーが高い。 エネルギーが低い方が安定するので、電子は原子核に近い内側の軌道から入る。 エネルギーバンドって? 原子が1個のときは
ボーアの原子モデルを用いて,水素原子がもつ電子のエネルギー準位を具体的に計算してみましょう! これまた興味深い結果! ! エネルギー準位が量子数 n だけで決まということは,言い換える分子が属する点群の表現と分子軌道の間に1対1の対応がある。縮重の組を ia, ib と呼ぶ。 波動関数とエネルギーは次のように表せる。 ψ ia = 2 m cos 2 πi (j – 1) Σ m j= 1 m χ j j = 1 , 2 , , m 原子の番分子中の電子は,分子全体に広がった分子軌道molecular orbital に入っていると考えられる。様々なエネル ギー準位を持った分子軌道があるが,基底状態(最もエネルギーの低い状態)では,低いエ
分子軌道準位図は左右の両端に原子状態での原子軌道を描き、その中心に相互作用した後に新しくできた分子軌道を描きます。 今回は 軌道しか考えないので、両端には 軌道1つしか描きません。 次に) c = 0 図2 ホルムアルデヒドの骨格構造 LCAO φ = c1˜1 c2˜O2 係数を決める方程式(ただし, で割る前の形で): CO= ∫ ˜1˜ O 2 dv O= ∫ ˜O 2 ^h˜ O 2 dv , の評エネルギー準位図で表される原子軌道は、下から(エネルギーが低い軌道から)1s < 2s < 2p
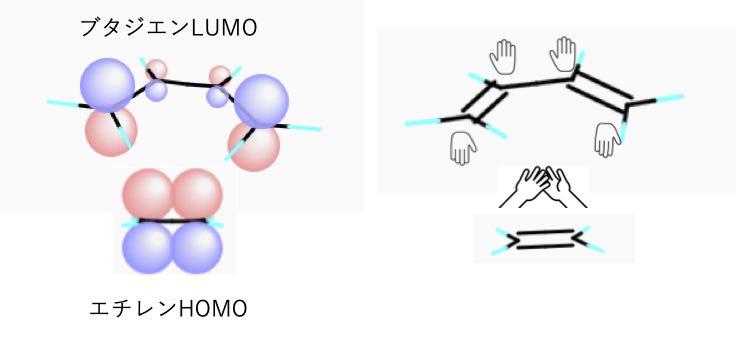



デジタル分子模型で見る化学結合 6 フロンティア分子軌道から 作られる直前の化学結合の様子を見る事ができる




ヒュッケル法 前編 手計算で分子軌道を求めてみた Chem Station ケムステ
すなわち,エネルギー行列を対角化することによって,分子軌道エネルギー (3)ブタジエンのπ分子軌道 ブタジエン分子は図68に示したように,すべての原子が同一面上にある平面分子であるI6 エネルギー準位、π電子エネルギー 2点×2 I1) 次の手順 a)d)に従い、エチレンのπ軌道を導出せよ。 a) 分子軌道を炭素原子 2p z軌道の線形結合で近似し(LCAO 近似)、一電子ハミルトニア ンh分子軌道は原子軌道の線型結合 それでは、エチレンの分子軌道を計算します。 今回の軌道計算に考慮する軌道はsp 2 混成軌道に垂直なp軌道のみです。 この2つのp軌道が分子になったとき、どのよ
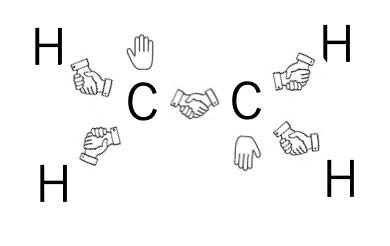



デジタル分子模型で見る化学結合 5 P結合とs結合の違いを分子軌道から理解する事ができる



2
回答数: 2 件 ブタジエンの混成軌道は全部sp2であることは分かったのですが 非局在化軌道だからトランス型が安定であることの理由がいまいちわかりません。 そこのところを詳しく教えてくださ4 に与えてある。分子軌道は、 エネルギーが高いほど破線で 示した節の数が多くなってい る。2pz 軌道にあった4 個の電 子はエネルギーの低い2 つの 分子軌道に入り、分子軌道を作った結果としてDVXα法によるエタン(ねじれ型)の分子軌道計算(Electronic Structure of Ethane) DVX エネルギー準位図を描けます L05 CONTRD C04D WAVNUM なし WAVNUM 分子軌道の番号表 contrd



エチレン D2h b4型分子 分子軌道計算 坂根弦太




ヒュッケル法 前編 手計算で分子軌道を求めてみた Chem Station ケムステ
そのπ電子は光を吸収して,最低非占分子軌道(あるいは最低空分子軌道)(Lowest Unoccupied Molecular Orbital;LUMO)に遷移する。 このHOMO-LUMO電子遷移はエネルギーの最も小さい遷原子は、その原子に特有ないくつかのエネルギー状態(エネルギー準位)をもっています。 エネルギーの低いものから、第1励起状態、第2励起状態(n =1, 2, )と名づけられています。 原子内のブタジエンには、2つのπ結合があります。 つまり、ブタジエンにある2つのπ結合は4つの電子を有していることが分かります。 そこでエネルギー順に電子を入れると、以下のようになります。 電子
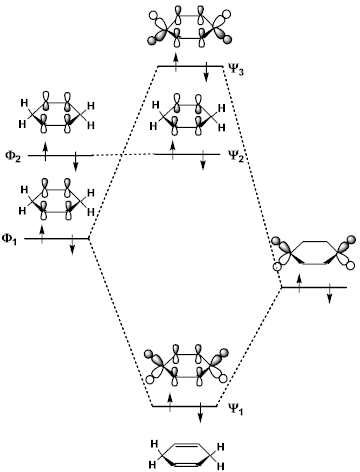



有機化学者のための分子軌道法




ヒュッケル法 前編 手計算で分子軌道を求めてみた Chem Station ケムステ
シクロブタジエンの基底状態は一重項か三重項になるかを考えています。 ヒュッケル近似でπ軌道エネルギーが e1=α+2β e2=α e3=α-2β 全π電子エネルギー e= 4α+4β というところまでは求めと計算され,安定化エネルギーは ( ) と 評価される。 ところで,ブタジエンは二重結合の位置が局在化し ないが,仮に二重結合がブタジエンの両端に局在す ると仮定すれば,安定化エネルギーはエ原子軌道のエネルギ-準位(縦軸linear scale) 炭素の混成軌道のエネルギー準位は? Energy / eV / kJ mol1 H 1s136 C 2s214 6478 C 2p114 C sp164 1535 C sp2



2



二原子分子のエネルギー準位図について 添付した図に関して質問がありま Yahoo 知恵袋
エネルギー準位はこんな感じです。 全体のエネルギーを比べてみると、単純な二重結合3つ分よりも 分だけ安定になっているため、電子の非局在化が起こります。 そして、各状態の原子軌道の寄与分子には多くの軌道 *(原子軌道1 ,分子軌道)があると考え る。分子のエネルギーが最も低い状態(基底状態)では,電 子はエネルギーの低い軌道から順に2個ずつ入る(図1)。 電子に占められホルムアルデヒド ( E)c ∑ ( !




分子軌道のエネルギー準位図 O2 2マイナスと2プラス O2 の2マイナスと 化学 教えて Goo



単純ヒュッケル法による分子軌道の計算と共鳴安定化
分子の面に垂直な軌道となっている。π電子の結合 はσ結合に比べ弱くエネルギー準位が深くないために隣の原子へ自由に飛び移る。 ヒュッケル法(Huc kel method) 分子の波動関数を = c1ϕ1 c2ϕ2目次 概要サブセクションを切り替えます 11 12 原子や分子のエネルギー準位 2 原子 原子サブセクションを切り替えます 21 本来のエネルギー準位 211 軌道状態のエネルギー準位 212 微細構造(



2



混成軌道
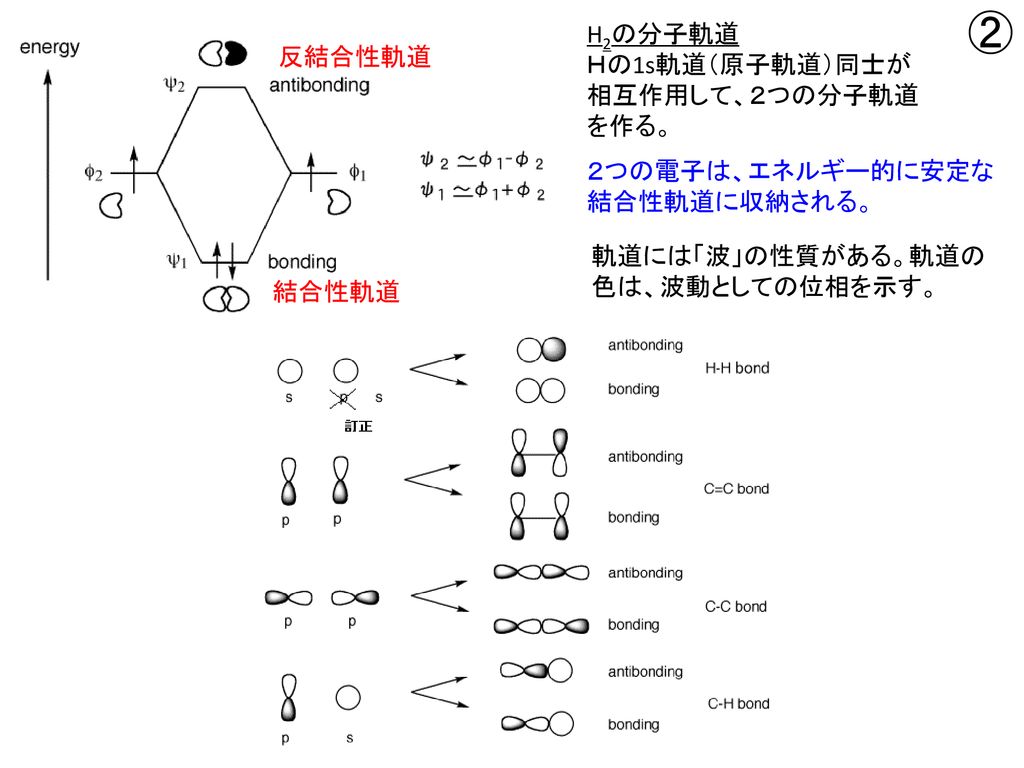



分子軌道理論 Molecular Orbital Theory Mo理論 Ppt Download
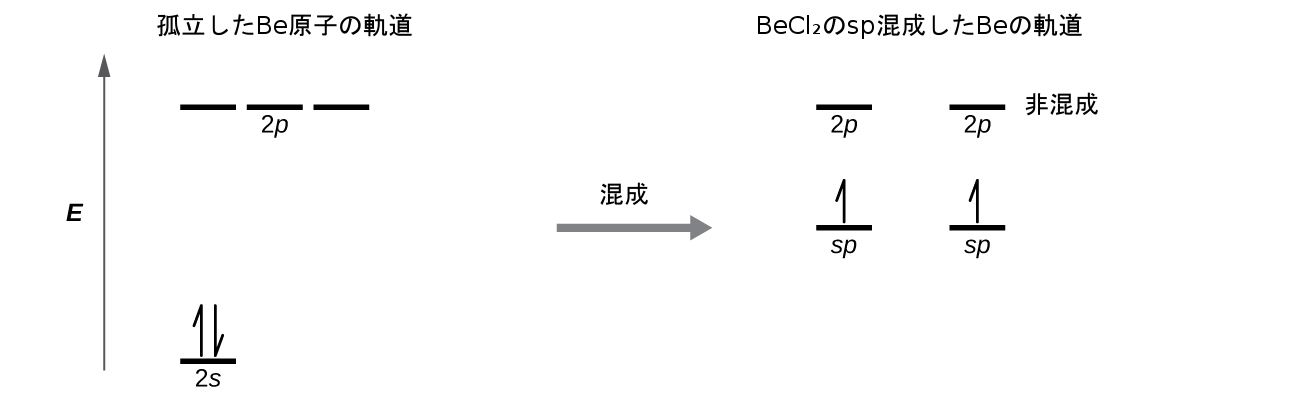



第8章 共有結合の高度な理論 化学 第2版



2



2
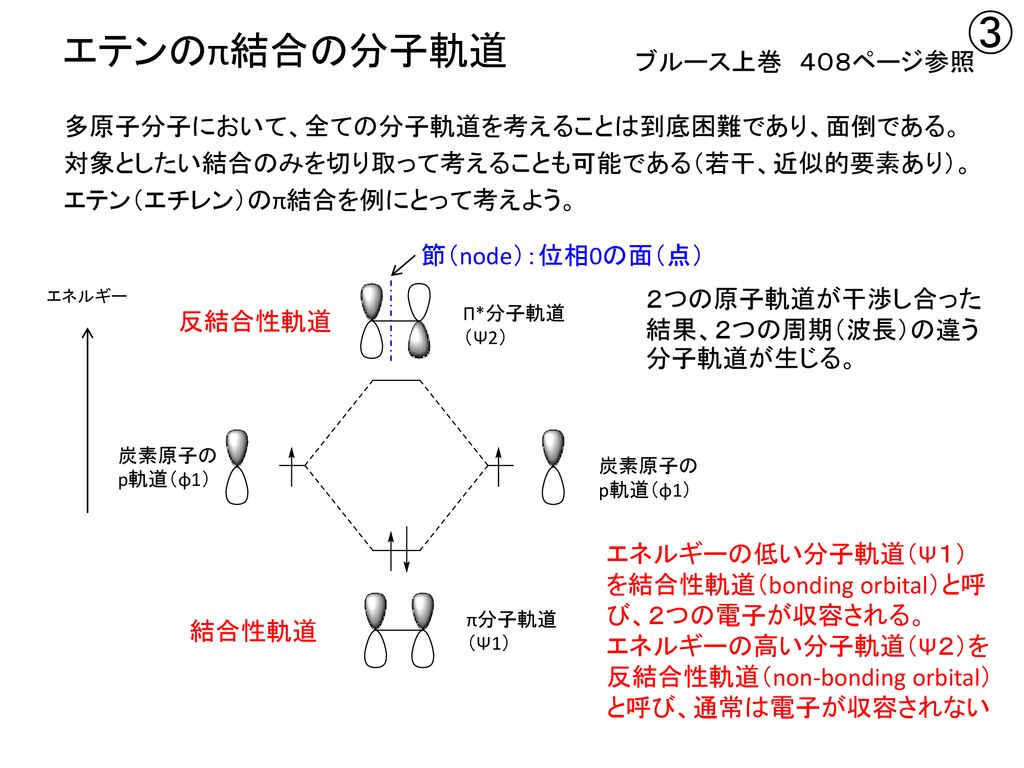



分子軌道理論 Molecular Orbital Theory Mo理論 Ppt Download



2



2



2
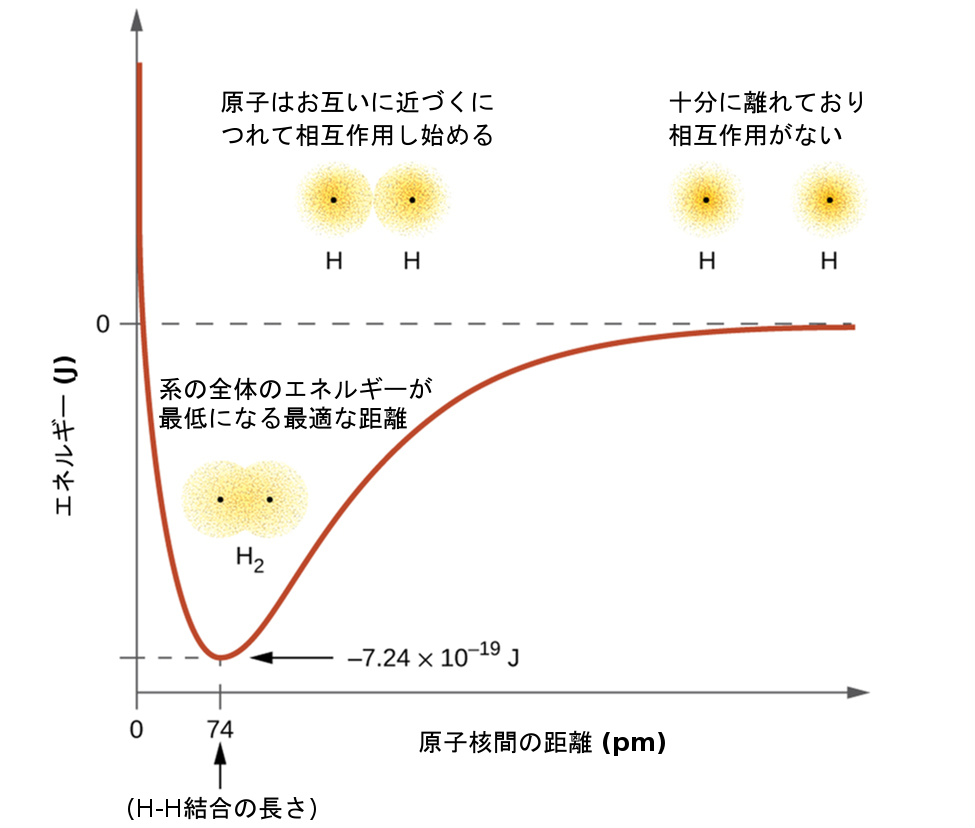



第8章 共有結合の高度な理論 化学 第2版



単純ヒュッケル法による分子軌道の計算と共鳴安定化



2



単純ヒュッケル法による分子軌道の計算と共鳴安定化
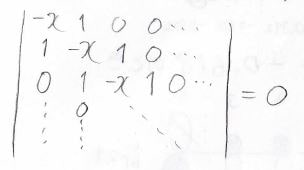



大学の物理化学 ヒュッケル法を使って実際にエネルギー準位を求めてみよう ばけライフ



単純ヒュッケル法による分子軌道の計算と共鳴安定化



2




有機化合物の構造と化学結合 有機化学の扉 Chemorgchem Com



Q Tbn And9gct6ztfmtpt6eobrwzwrjtdjf6czrsi7hhyxboiuqzfczyljh Ij1nx7 Usqp Cau



2




Hp1 Gif



単純ヒュッケル法による分子軌道の計算と共鳴安定化




大学の物理化学 ヒュッケル法を使って実際にエネルギー準位を求めてみよう ばけライフ




芳香族化合物とは コトバンク
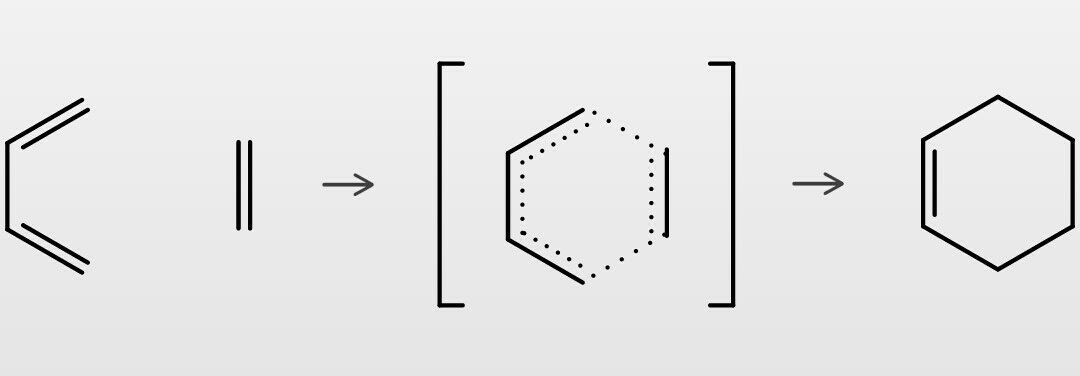



ディールスアルダー反応 この世を科学的に知ろう




大学の物理化学 ヒュッケル法を使って実際にエネルギー準位を求めてみよう ばけライフ
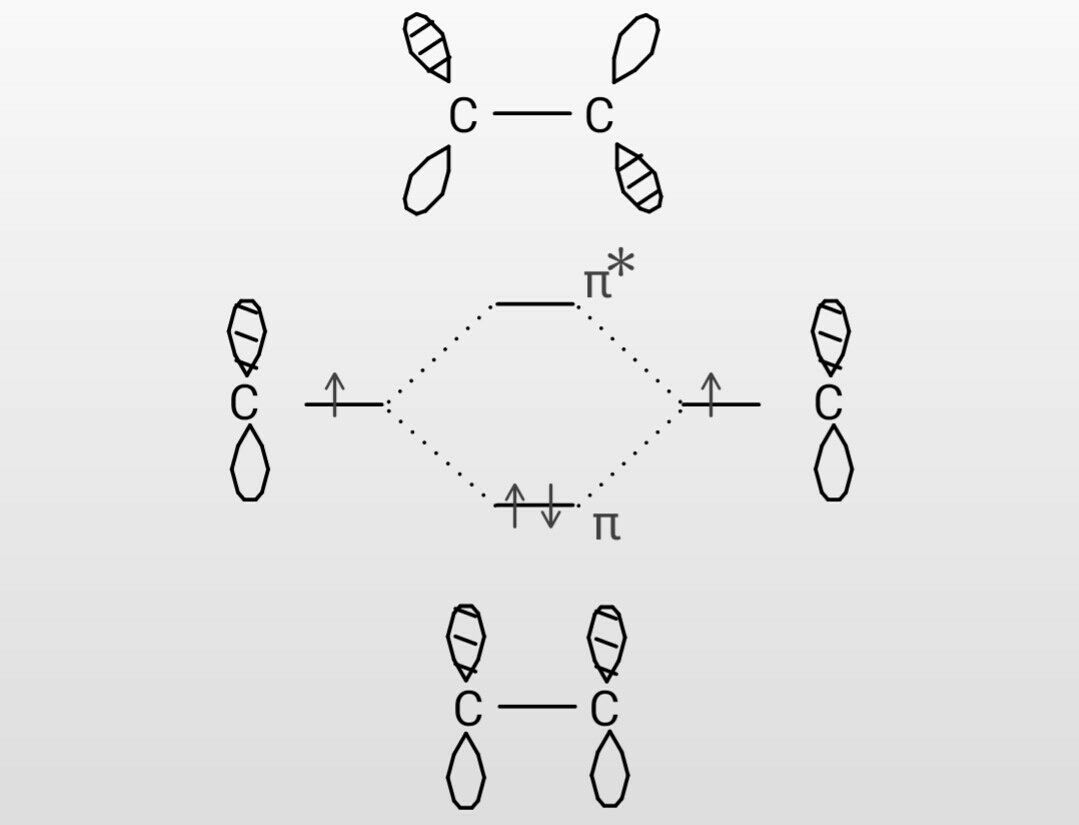



ツァイゼ塩 この世を科学的に知ろう



化学についてで酸素のエネルギー準位図は写真であってますか 合ってると Yahoo 知恵袋
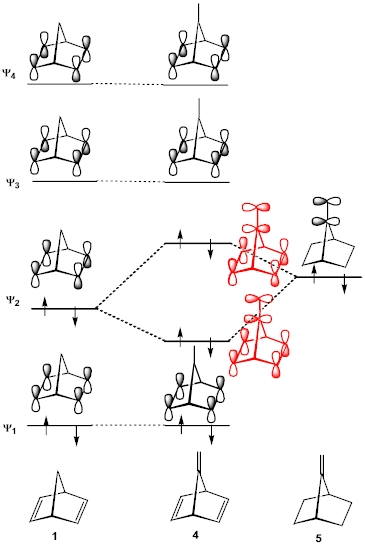



有機化学者のための分子軌道法




量子コンピューターによるヒュッケル分子軌道計算 東京大学 大学院理学系研究科 理学部



かがくののおと




ディールス アルダー反応とは 化学系リケジョ大学生がわかりやすく解説 リケジョのたまり場
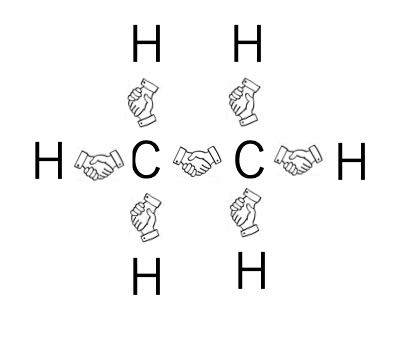



デジタル分子模型で見る化学結合 5 P結合とs結合の違いを分子軌道から理解する事ができる



Co 一酸化炭素 のmoエネルギー準位図を示して考察せよ という問題なのです Yahoo 知恵袋



Ch3 の分子軌道の構築



かがくののおと
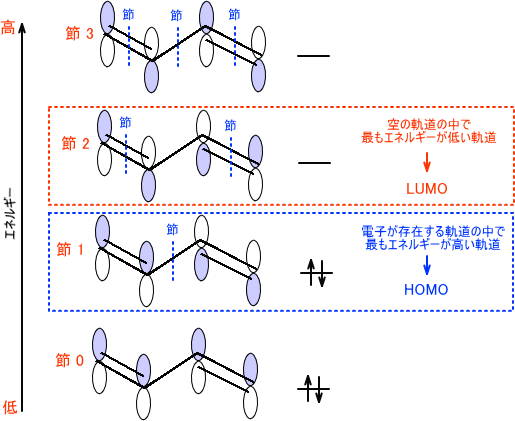



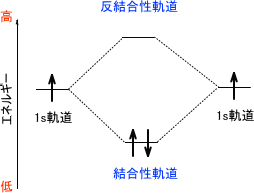
結合性軌道と反結合性軌道 Homoとlumo



かがくののおと




大学の物理化学 ヒュッケル法を使って実際にエネルギー準位を求めてみよう ばけライフ




Pdfファイル
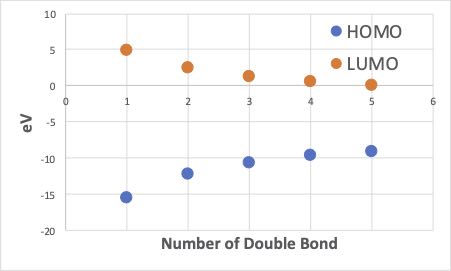



Cndo 2を使った分子軌道計算




量子化学 混成軌道をわかりやすく解説 見分け方は超簡単 大学生のための量子化学
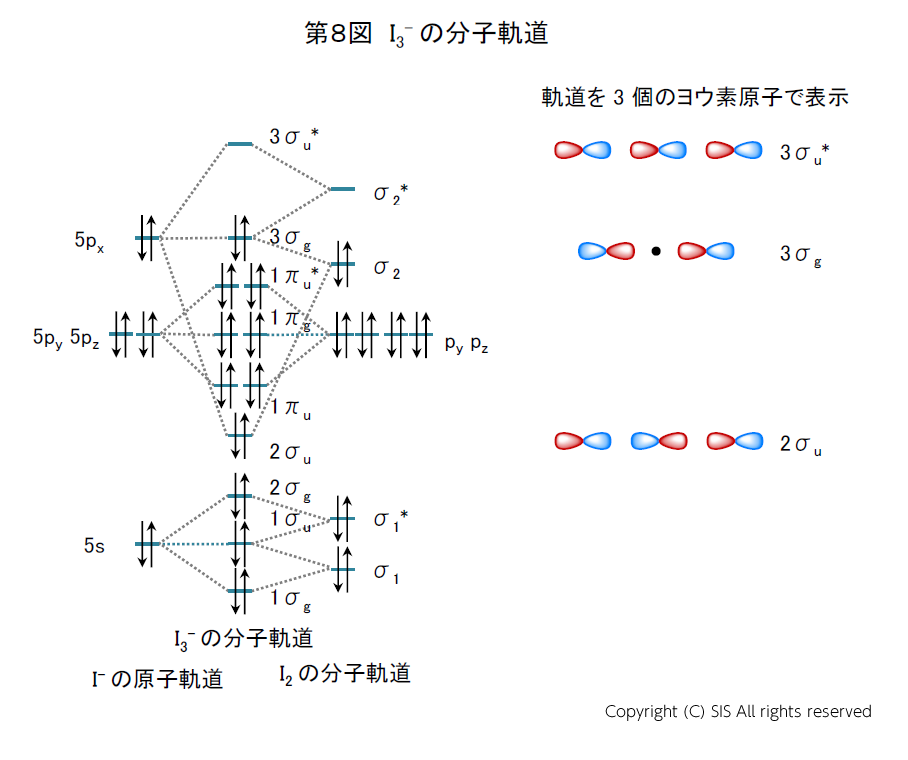



ヨウ素とは ヨウ素学会
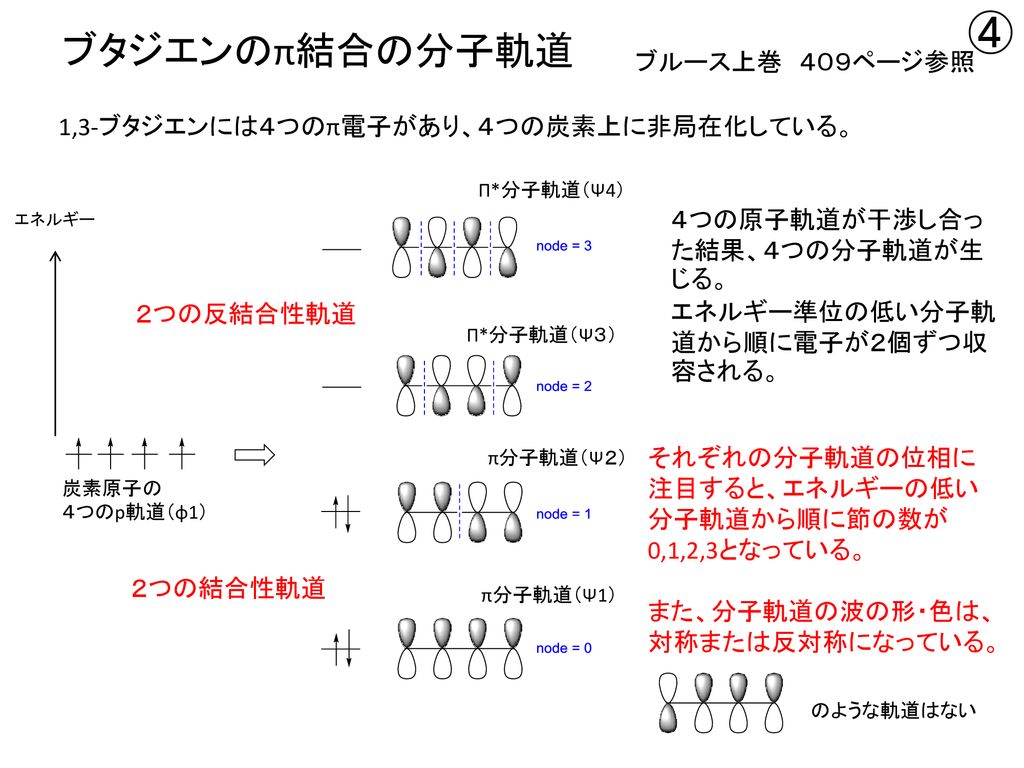



分子軌道理論 Molecular Orbital Theory Mo理論 Ppt Download




1 3 ブタジエンのp軌道の分子軌道の質問です 光過程による環化反応は 化学 教えて Goo



2




ヒュッケル法 前編 手計算で分子軌道を求めてみた Chem Station ケムステ



2
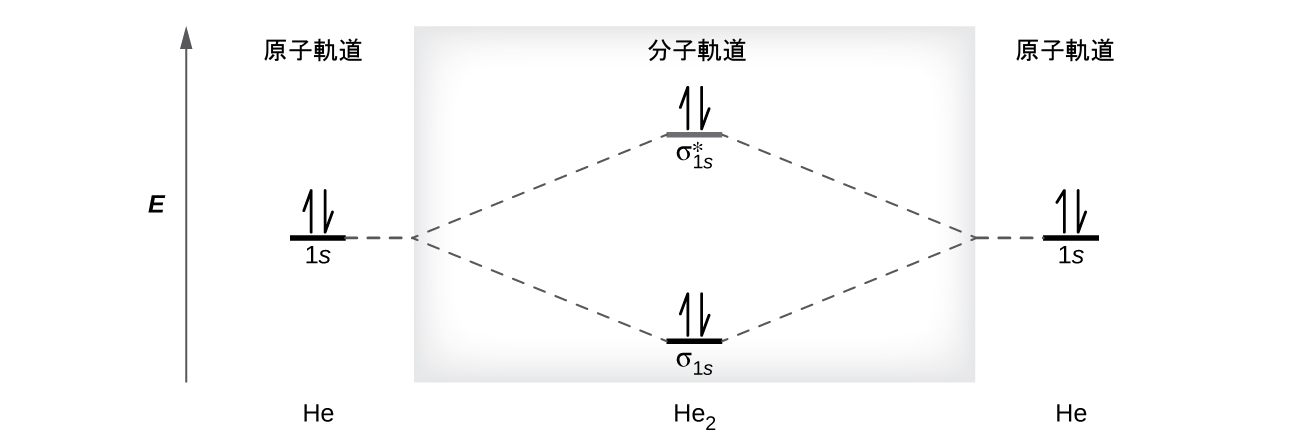



第8章 共有結合の高度な理論 化学 第2版




反結合性軌道 Youtube



2



Q Tbn And9gctw1c Gm Gngmfvddof1tvoqlnskjwtdlbht9d1tl 9wix8law3prhe Usqp Cau



2



2




16 共役p電子系 単純 Huckel 法
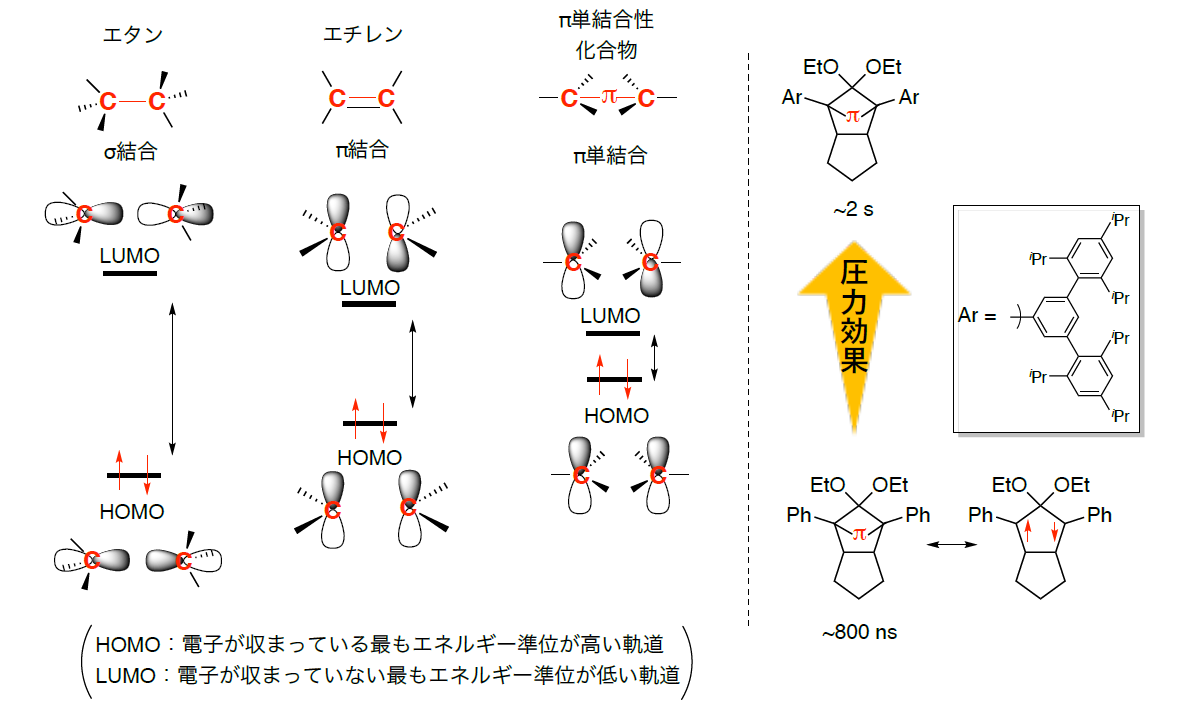



研究成果 炭素 炭素p単結合性化合物の寿命を圧力効果により約1000倍長くすることに成功 広島大学



講義 有機化学1 第15回目の講義から 1 分子軌道法について エチレンとブタジエンのp結合について 片桐教授 東京工科大学 工学部 応用化学科 ブログ



2
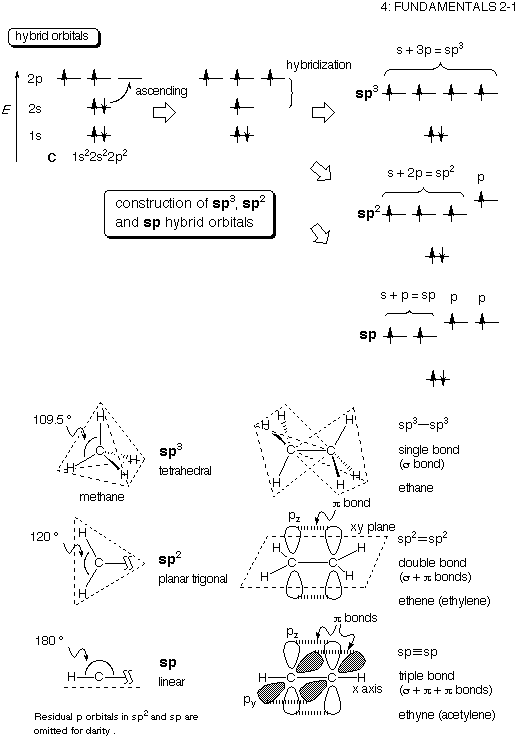



基礎有機化学4 基礎2 1



2



単純ヒュッケル法による分子軌道の計算と共鳴安定化
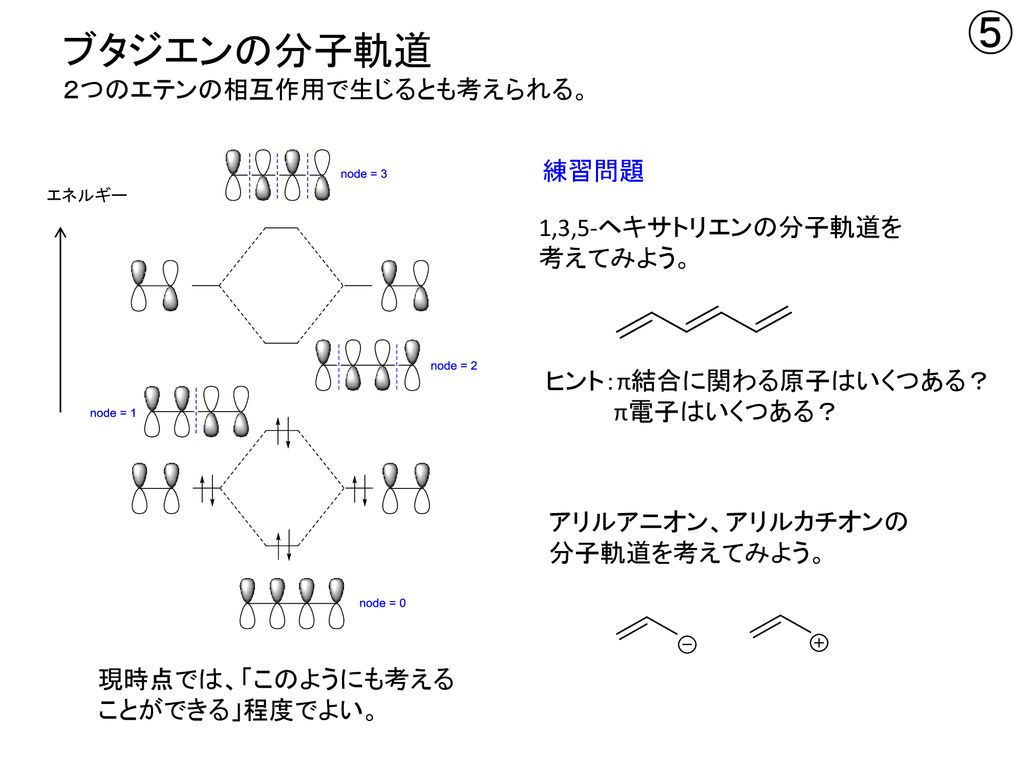



分子軌道理論 Molecular Orbital Theory Mo理論 Ppt Download



2



Q Tbn And9gcsjoqp4bbwg Nx7gxwmgt2ad1 6wjgims1 Tieqrlo5z6oifkqwv6gv Usqp Cau



Ttf Pc Uec Ac Jp



Ch3 の分子軌道の構築



平成18年度 構造有機化学 講義スライド テーマ 芳香族性 奥野 恒久 Ppt Download



書籍紹介 図説 量子化学 大野公一 山門英雄 岸本直樹 共著 化学



Cndo 2を使った分子軌道計算




日曜化学 3 分子軌道法と可視化 Python Matplotlib Tsujimotterのノートブック



ディールスアルダー反応 この世を科学的に知ろう




大学の物理化学 ヒュッケル法を使って実際にエネルギー準位を求めてみよう ばけライフ




混成軌道 Wikiwand



C2 とf2 の分子軌道による電子配置をエネルギー準位図で示し こ Yahoo 知恵袋




分子軌道理論 Molecular Orbital Theory Mo理論 Ppt Download



2



Ch3 の分子軌道の構築



2



2
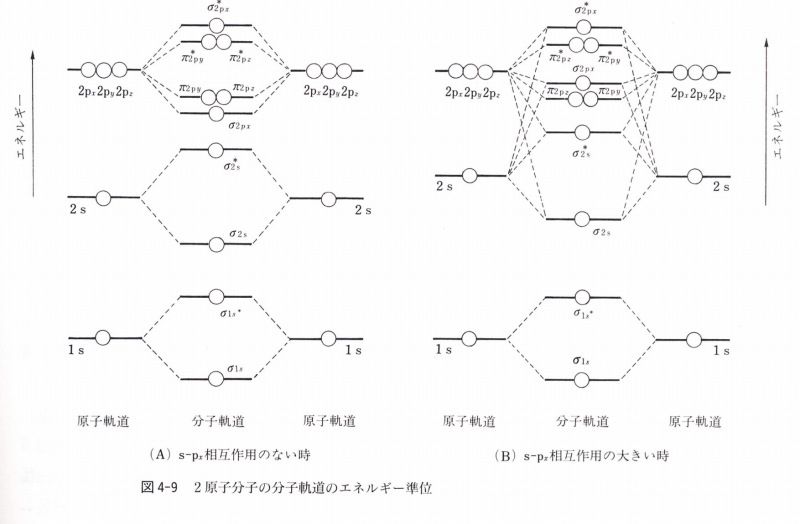



第12講義 混成軌道 3つの混成sp Sp2 Sp3 Blogchemistry




フロンティア軌道 石くれと砂粒の世界



分子軌道の書き方が全く分かりません このn2とo2の分子軌道がど Yahoo 知恵袋



Q Tbn And9gcspx97f0ujod42gquiv0glbdhwzh Bkqtwjbqe8fwzwzzasvgaodtw8 Usqp Cau



2
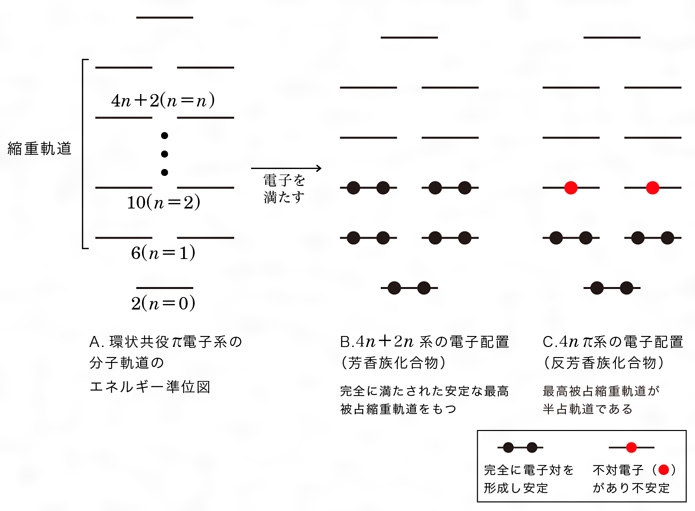



芳香族化合物とは コトバンク
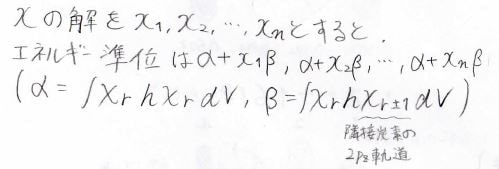



大学の物理化学 ヒュッケル法を使って実際にエネルギー準位を求めてみよう ばけライフ
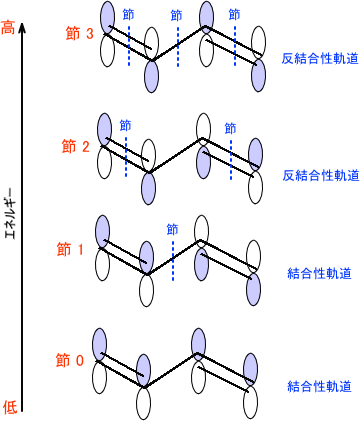



結合性軌道と反結合性軌道 Homoとlumo
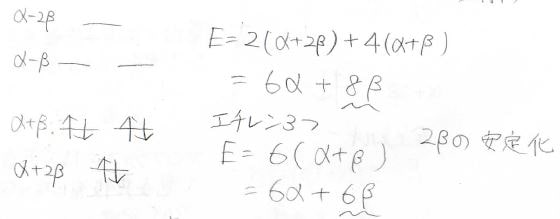



大学の物理化学 ヒュッケル法を使って実際にエネルギー準位を求めてみよう ばけライフ



2



2



Ch3 の分子軌道の構築



結合性軌道と反結合性軌道 Homoとlumo



0 件のコメント:
コメントを投稿